부메뉴
FAQ
자주 묻는 질문
고객 문의가 많은 항목을 정리했습니다. 키랄칼럼에 대해 도움이 필요 할시에는, 꼭 봐주세요.
- 질문Immobilized type 키랄 컬럼과 기존의 Coated-type 키랄 컬럼의 차이점, 공통점은 무엇입니까?
- 답변
기존의 Polysaccharide-based CSP, Coated-type-Normal Phase 키랄 컬럼과 Immobilized type 키랄 컬럼의 가장 중요한 차이는 이동상에 대한 견고성과 안정성입니다.
Immobilized type 키랄 컬럼의 Chiral 고정상은 Coated-type 키랄 컬럼과는 달리 실리카겔에 고정화되어 있습니다.
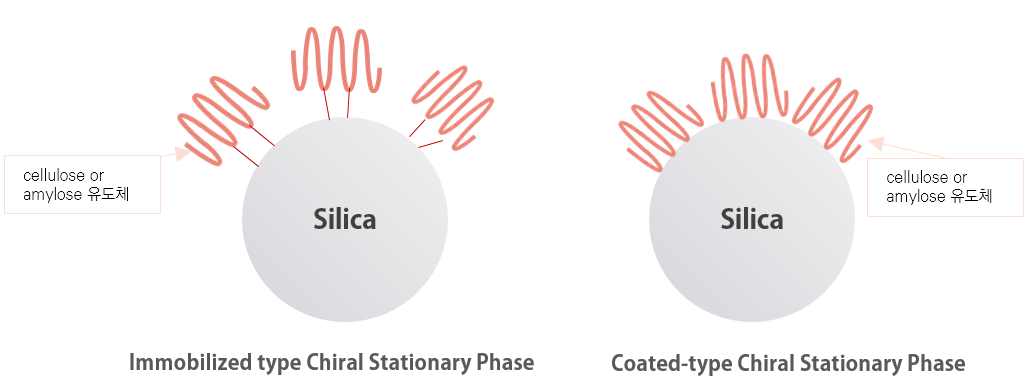
가. Immobilized type 키랄 컬럼은 다양한 용매(MC, EA, MTBE 등)를 사용할 수 있으며, 용매로 인한 컬럼 충진제의 성능 변화 및 컬럼이 망가질 걱정을 하지 않으셔도 됩니다. 사용 금지 용매 (MC, EA, MTBE 등)에 의한 CSP의 변화 및 손상될 염려가 없습니다. 기존 Coated-type 키랄 컬럼에서 이동상 용매 선택은 매우 제한적이었으나 Immobilized type 키랄 컬럼에서는 모든 유기 용매를 사용 할 수 있습니다.
나. Immobilized type 키랄 컬럼을 사용하면, 분석 가능한 키랄 물질 범위가 더욱 확대됩니다. Immobilized type 키랄 컬럼은 이동상 용매 선택이 크게 넓어지므로 기존의 이동상 (Hexane/Alcohol)으로는 분리 할 수 없는 화합물의 분리를 기대할 수 있습니다. Immobilized type Chiral 컬럼을 사용하여 분석방법을 개발하실 때 본 홈페이지에 있는 핸드북을 참조하십시오.
다. Immobilized type 키랄 컬럼과 Coated-type 키랄 컬럼은 키랄 선택기 (Chiral selector)에서도 공통점과 차이점이 있습니다.
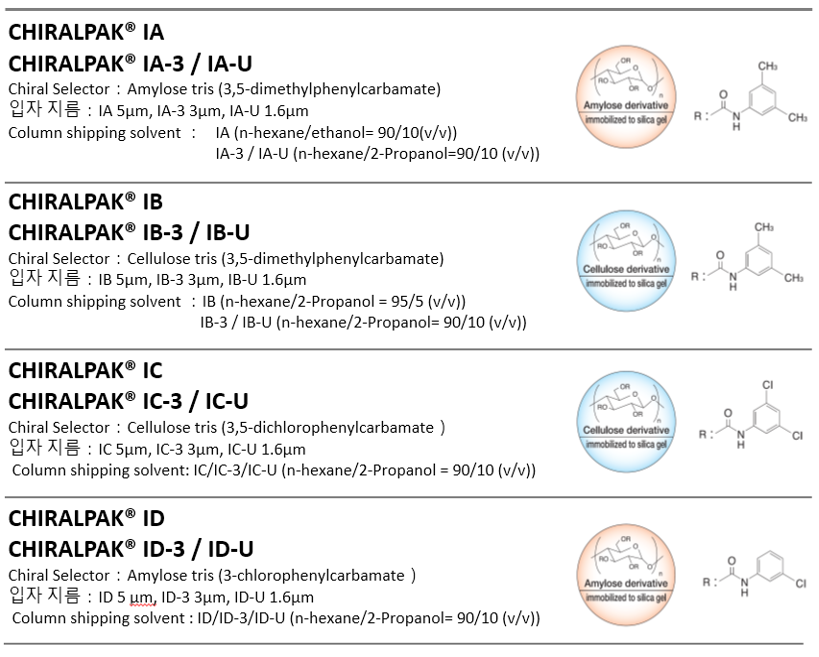
CHIRALPAK IA의 Chiral 선택기는 CHIRALPAK AD-H와 같은 3,5-Dimethylphenylcarbamate 유도체입니다.
CHIRALPAK IB의 Chiral 선택기는 ChiralCEL OD-H와 같은 3,5-Dimethylphenylcarbamate 유도체입니다.
CHIRALPAK IC는 Cellulose의 3,5-Dichlorophenylcarbamate 유도체입니다.
CHIRALPAK ID는 Amylose의 tris(3-Chlorophenylcarbamate 유도체입니다.
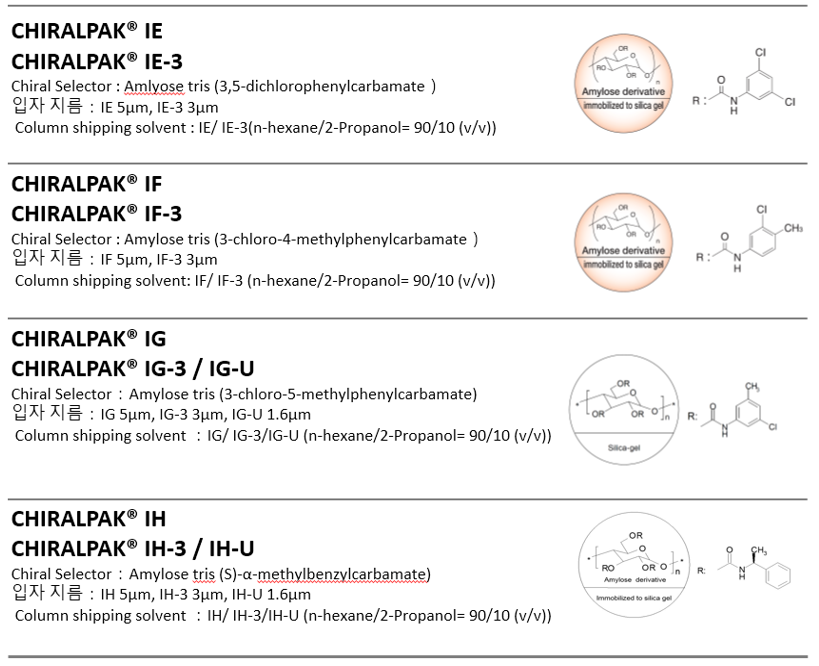
IC와 ID는 Coated-type 키랄 컬럼에는 없는 새로운 Chiral 선택기 입니다.
IC의 Chiral 선택기는 비대칭 식별 능력이 높은 것이 였으나 일반적인 유기용매에 용해되기 쉽기 때문에 Coated-type Chiral 컬럼으로 제작되기 어려운 점이 있어 고정화 기술 탄생에 의해 제품화 된 Chiral 컬럼입니다.
라. CHIRALPAK IA, AD-H는 같은 Chiral selector이나 고정상의 결합 방식의 차이가 있습니다.
Immobilized type 키랄 컬럼은 Chiral 고정상이 실리카에 고정화됨으로서 Coated-type 키랄 컬럼과 비교하여 선택성에 약간의 차이가 발생합니다. 분리능이 높거나 낮을 경우도 있습니다. 하지만 Immobilized type 키랄 컬럼의 각 용매에 대한 높은 안정성과 다양한 용매를 사용하여 분리능을 향상 시킬 수 있는 가능성을 생각하면 Immobilized type Chiral 컬럼을 선택하는 것이 좋습니다. 또한 위에서 설명한 바와 같이 CHIRALPAK IC, ID는 Coated-type 키랄 컬럼에는 없는 특별한 키랄 컬럼이기 때문에 특별한 분리를 기대할 수 있습니다. - 질문DAICEL 키랄 컬럼에서 기울기 용리(gradients mode)를 사용 할 수 있습니까?
- 답변
DAICEL 키랄 컬럼에서 기울기 용리를 사용하는 것이 효과적이지 않을 수 있습니다.
기울기 용리 모드에서 분석 시간 단축되더라도 분석 종료 후 컬럼에서 초기 이동상 조건으로 평형화하는 시간이 더 걸릴 수 있기 때문입니다.
조건 검토 시 Chiral 컬럼도 기울기 용리 (gradient mode)가 효과가 있습니다.
기울기 용리 (gradient mode)를 걸어 Chiral 컬럼에서 분석을 할 때, 샘플 농도를 너무 높지 않게 조건 검토하시는 것이 좋습니다.
기울기 용리를 이용하면, 분리능 향상 및 머무름이 서로 다른 물질이 용출 되지 않는 등의 문제를 피할 수 있습니다.
수용액 이동상의 조제법"제 1 권장 이동상"
포름산 수용액 (pH 2)의 조정법
pH 2 가 될 때까지 증류수에 포름산 를 추가합니다.20 mM Ammonium bicarbonate 수용액 (pH 9)의 조정법
1 L의 메스 플라스크에 탄산 수소 암모늄 (NH4HCO3 FW : 79.06)을 1.58 g을 취한 후, 증류수를 넣어 1L로 맞춥니다 (20 Mm).탄산 수소 암모늄 수용액을 비커에 붓고 pH 측정기를 사용하여 pH9 때까지 diethylamine을 추가합니다.
"제 2 권장 이동상"
Phosphoric acid 수용액 (pH2) 조제법
pH 2 가 될 때까지 증류수에 포름산 를 추가합니다.20 mM 붕산 완충액 (pH9) 조제법
1 L의 메스 플라스크에 붕산 (H3BO3 FW : 61.83) 1.24 g을 취한 후, 증류수를 넣어 1L로 맞춥니다 (20 mM).
Sodium tetraborate decahydrate 7.63 g을 두 번째 1L의 메스 플라스크에 취한 후, 증류수를 넣어 용해시킵니다 (20 mM).붕산 나트륨 완충액 500 ml를 1 L의 비커에 옮긴 후, pH 측정기를 사용하여 pH 9 까지 붕산 수용액을 넣어 제조합니다.
100 mM Potassium hexafluorophosphate 완충액의 조제법
Potassium hexafluorophosphate (KPF6 FW : 184.07) 9.2 g을 500 ml 메스 플라스크에 넣고, 표준선까지 증류수를 추가합니다 (100 mM).Potassium hexafluorophosphate 수용액을 1L 비커에 옮기고 pH 측정기를 사용하여 pH 2 가 될 때까지 Phosphoric acid 수용액을 넣습니다.
"CROWNPAK 이동상"
pH 1 과염소산 용액 조제법
시판의 70 % 과염소산 용액 16.3g을 1L의 메스 플라스크에 취한 후, 증류수를 넣어 1L를 채웁니다.
다른 pH의 수용액은 다음과 같이 준비 할 수 있습니다.
1. pH 2.0 - pH 1 과염소산 용액 100 ml를 1L 메스 플라스크에 취한 후, 증류수를 넣어 1L를 채운다.
2. pH 1.5 - pH 1 과염소산 용액 316 ml를 1L 메스 플라스크에 취한 후, 증류수를 넣어 1L를 채운다.
3. pH 1.3 - pH 1 과염소산 용액 500 ml를 1L 메스 플라스크에 취한 후, 증류수를 넣어 1L를 채운다.
(기준량이므로 pH 미터로 pH를 확인하십시오.) - 질문가드가 필요합니까?
- 답변
분석 컬럼 및 세미 분취 컬럼을 사용시에는 가드를 사용하십시오.
충전제에 흡착하는 불순물이나 충전제를 용해시킬 수 있는 용매로부터 본체 컬럼을 보호하는 것을 목적으로 가드 컬럼을 사용합니다.
본체 컬럼을 장기간 안정적으로 사용하기 위해 가드 컬럼 사용하시는 것을 권장합니다.
가드의 교환시기는 Chromatogram의 형상으로 판단하십시오.
[가드 컬럼 교체 시기 체크 포인트]피크의 간격이 좁아짐
피크 대칭성이 떨어짐 (피크 폭의 넓어짐, Peak Shoulder 등)
시스템 압력의 증가가드 컬럼은 분석 컬럼 및 세미 분취 컬럼과 동일한 충전제가 충전 된 가드 카트리지 또는 가드 컬럼을 사용하십시오.
본체 컬럼과 다른 유형의 가드를 사용하면 이상 흡착 등에 의해 분리에 좋지 않은 영향을 미칠 수 있습니다.
가드 컬럼 말단은 본체 컬럼과 같은 모양입니다. 가드 컬럼과 본체 컬럼을 짧은 라인으로 연결하십시오.
3μm 시리즈, 용제 형 시리즈, H 시리즈, R / RH 시리즈의 가드 컬럼은 카트리지 타입으로 되어 있습니다.가드 카트리지의 사용은 가드 카트리지 홀더가 필요합니다.
각 컬럼 별로 카트리지를 보유하고 있지만, 가드 카트리지 홀더는 단백질계 컬럼을 제외한 모든 가드 카트리지에서 공통적으로 사용하실 수 있습니다.
- 질문DAICEL 키랄 컬럼은 SFC에서 사용할 수 있습니까?
- 답변
DAICEL Chiral 컬럼은 SFC에서 높은 성능을 보여줄 수 있습니다. SFC 이동상은 주로 이산화탄소가 사용되지만, Hexane과 유사한 특성이 있습니다.
SFC에서는 HPLC 에서 사용할 수 있는 모든 용매 (Alcohol, Acetonitrile)를 Modifier로 사용할 수 있습니다.
일반적으로 Chiral의 선택성은 SFC와 HPLC는 동일하지만 이산화탄소의 큰 확산 속도로 인해 SFC가 더 높은 유속에서 분리 효율이 높고, 높은 분리도를 얻을 수 있습니다. 또한 HPLC에서 Carboxylic acid을 분석하는 경우 이동상에 산성 첨가제의 첨가가 필요하지만, SFC에서는 첨가제를 추가하지 않아도 날카로운 피크를 얻을 수 있습니다.
컬럼에 걸리는 압력 및 압력 안정성이 중요하며, SFC의 높은 압력이 컬럼에 좋지 않은 영향을 미치는 것이 아닌가 하는 우려가 있을 수 있습니다.
그러나 이산화탄소의 장점은 점도가 낮다는 것이고, 컬럼에 걸리는 압력은 HPLC보다 SFC가 훨씬 낮습니다.
그리고 다이셀 컬럼은 SFC 조건에서 매우 안정적입니다.
SFC 용 Chiral 컬럼을 사용하지 않을 경우에는 컬럼 내의 이산화탄소를 2 - Propanol 또는 Ethanol로 대체하고 밀봉하여 보관하는 것이 좋습니다.
헥산을 포함한 용매에 보관하면 이산화탄소가 헥산을 효과적으로 교체하기 어렵기 때문에 바탕선 노이즈가 발생할 수 있습니다. - 질문Daicel 키랄 컬럼을 사용 할 때, 일반적인 주의사항이 궁금합니다.
- 답변
1. 컬럼에 동봉된 사용 설명서를 반드시 읽어주십시오.
Immobilized chiral 컬럼과 coated chiral 컬럼은 사용 방법 및 주의사항이 다르며, coated chiral 컬럼은 고정상의 종류와 고정상 입자 크기 마다 사용할 수 있는 이동상의 조성이 다릅니다.
2. 컬럼을 HPLC에 연결하기 전, HPLC 장비 전체 (오토샘플러, 루프, 주입 니들, 오토샘플러 세정액, 시스템 라인 및 검출기를 포함하는 기기 전체)를 적절한 용매로 치환하십시오.
3. 컬럼을 최대 수명까지 사용하기 위해 권장 용매만을 사용하십시오. 권장 용매 이외의 용매 사용은 컬럼의 수명을 단축시킵니다. 가능하시면 CTK 로 문의하십시오.
주의 : 컬럼 내에 동봉된 사용 설명서의 권장 용매와 그 비율 이외의 모든 용매의 혼합에 대해서 안정성과 장기간 사용 가능성에 대한 평가는 되어 있지 않습니다.
4. 간단한 이동상 조성을 사용하십시오. 일반적으로 카이랄 물질은 순상 분석 이동상으로 헥산 / 2-프로판올 = 95 / 5 ~ 50 / 50 (v / v), 헥산 / 에탄올 = 95 / 5 ~ 50 / 50 (v / v)등의 간단한 조성으로 분리됩니다.
주의 : Coated chiral 컬럼 중에는 이동상 중 알코올 농도의 제한이 있는 컬럼도 있습니다 (용매의 사용 제한은 각 컬럼에 첨부된 설명서를 참조하십시오). 분리 조건 검토 시, HPLC Grade의 에탄올 사용을 권장합니다.
응용 : HPLC Grade의 에탄올은 2-프로판올 5% 또는 메탄올 5%의 첨가로 성질이 달라질 수 있습니다. 그러나 절대로 벤젠 및 기타 알코올 이외의 변성제로 변성시킨 에탄올을 사용하지 마십시오.5. 컬럼을 HPLC에 연결하신 후, 이동상을 흘려 검출기의 시그널을 안정화 시켜 주십시오. 일반적으로 1 ml/min의 유량으로 30분 정도 걸립니다. 낮은 유속이거나 검출기의 감도가 높은 경우, 평형에 시간이 더 걸릴 수 있습니다.
6. 불용물이 샘플에 있으면 안됩니다. 불용물은 컬럼의 입구를 막음으로써, 많은 문제를 일으킵니다. 기기 주입 전, 시린지 필터 또는 가드 컬럼을 이용하면, 본 컬럼을 보호할 수 있습니다.
7. Achiral 불순물 및 chiral 물질을 구별하기 위해, 다 파장 검출기 (광학 이성질체의 피크는 UV Spectrum이 일치합니다)를 사용하거나 선광검출기 또는 RI검출기등 다른 검출기를 병용하는 것이 좋습니다. 비 대칭 중심 (카이랄 탄소 등 입체 중심)이 여러 개라면, 분리되어 검출되는 피크의 개수도 여러 개가 되며, 모든 피크의 UV Spectrum은 동일합니다.
8. 컬럼에서 샘플의 석출 또는 solavation을 억제하기 위해 이동상과 같은 용매로 샘플을 용해시켜 주십시오. 이동상에 샘플이 녹지 않는 경우, 당사로 연락주시기 바랍니다.
9. 분석이 완료되면 적절한 보관용 용매로 컬럼을 세척하십시오.
완충액 또는 첨가물을 이동상으로 사용한 경우, 염 또는 첨가물을 포함하지 않는 분석 이동상 조성으로 컬럼을 세척하신 후, 권장 보관용 용매로 대체하십시오. 컬럼을 장기간 사용하지 않을 경우에는 컬럼을 HPLC 장치에서 분리하여, 마개를 닫아 보관하십시오.
사용시 주의 사항
1. 허용 최대 압력 이상으로 컬럼을 사용하지 마십시오.
2. 컬럼의 취급 설명서에 기재되어 있지 않은 용매를 샘플 용매와 이동상으로 사용하지 마십시오. 컬럼 종류 별로 사용 가능한 용매와 용매 조성비가 다릅니다. 좋은 분리가 되었던 이동상 조성이 다른 컬럼에서는 사용하지 못할 수 있습니다.
3. 장기감 컬럼을 보관하는 경우, 완충액 또는 첨가제가 컬럼에 잔류하지 않도록 하십시오. 설명서에 기재되어 있는 각 컬럼의 권장 보관 방법은 컬럼 마다 다릅니다. 반드시 확인코 보관하여 주십시오.
4. 컬럼에 동봉되어 있는 설명서 및 Performance test 결과를 잘 보관하십시오. 설명서를 버리거나 잃어버리신 경우, 자사로 문의 부탁드립니다. Performance test는 분리에 문제가 생겼을 때, 새 제품에 비해 분리능이 유지되고 있는지 확인하는데 사용 하실 수 있습니다.
- 질문스탠다드 타입의 컬럼과 H 시리즈의 컬럼 그리고 3μm의 컬럼의 차이를 알려주세요.
- 답변
CHIRALCEL과 CHIRALPAK은 10μm의 입자를 사용하였으며,
H 시리즈의 CHIRALCEL, CHIRALPAK 컬럼 (상품명에 H가 붙는 것)에는 직경 5μm 입자가 사용 되었습니다.
3μm 시리즈 CHIRALCEL, CHIRALPAK 컬럼 (상품명에 3이 붙는 것)에는 직경 3μm 입자가 사용되어 있습니다.
H 시리즈, 3μm 시리즈의 컬럼은 동일한 Chiral 고정상이 사용됩니다 (예 : AD 컬럼과 AD-H 컬럼과 AD-3 같은 Chiral 고정상이 사용되어 있습니다).충전제의 입자 크기가 작아지면 스탠다드 타입의 컬럼 (10μm) 과 동일한 선택성을 가지면서, 더 높은 분리능을 발휘합니다.
따라서 H 시리즈의 컬럼이나 3μm 시리즈의 컬럼은 기존 10μm 제품 컬럼에서는 어려웠던 분리 그리고 불순물의 피크가 목적 성분 피크와 겹치는 분리에 더 효과적입니다. 분석의 속도를 중시하는 경우, 입자 크기가 작고 길이가 짧은 컬럼을 사용하는 것이 좋습니다.
역상용 컬럼 RH 시리즈는 직경 5μm 입자를 사용하며, 각 제품에 대하여 3μm 컬럼도 제조하고 있습니다.
Immobilized type Chiral 컬럼 관해서는 분석용 컬럼은 직경 5μm 입자 (CHIRALPAK IA, IB, IB N-5, IC, ID, IE, IF, IG, IH) 와 3μm 입자 (CHIRALPAK IA-3, IB-3, IB N-3, IC-3, ID-3, IE-3, IF-3, IG-3, IH-3) 그리고, 1.6μm 입자 (CHIRALPAK IA-U, IB-U, IC-U, ID-U, IG-U, IH-U) 가 사용되고 있습니다. - 질문분석용 컬럼 조건에서 세미 분취용 컬럼 조건으로 스케일업(scale-up)을 어떻게 하면 좋을까요? 샘플 로딩양은 얼마나 되나요?
- 답변
분석 조건에서 세미 분취 조건으로의 확장은 간단한 계산만으로 아주 쉽게 할 수 있습니다.
Racemic mixture의 광학 분리가 목적인 경우, 우선 분석 컬럼을 사용하여 최대 샘플 주입량 조건을 결정하십시오.
분리 가능한 조건이 여러 개 일 경우, 각각의 조건에 주입량 시험을 실시하여 가장 샘플 주입량을 증가 시킬 수 있는 조건을 선택하십시오.샘플 주입량 시험을 실시 할 때는 먼저 Racemic mixture 를 이동상과 같은 조성의 용매에 최대한 고농도가 되도록 용해시킵니다.
검출 파장은 목적물 피크가 검출 될 수 있는 파장으로 설정하고, Racemic mixture가 분리능이 1.5가 되는 지점까지 주입량을 늘려 과부하가 되기 직전의 주입량을 확인합니다.
주입량의 실험 값 (WE)은 Racemic 용액의 [최대 농도 (Cmax) × 과부하가 되기 직전의 최대 주입량 (VAmax)] 이라는 관계식에서 구할 수 있습니다.대략적인 기준으로 분석 컬럼에서 일반적인 WE 값은 1 ~ 10mg/injection입니다.
0.46 × 25cm의 분석 컬럼의 상대적인 주입량 (LCR)을 1로 가정하면 각 컬럼 내경에 따른 주입량과 유속은 아래 표와 같이 됩니다.
"샘플 주입량은 얼마나 되나요?"라는 질문의 대답은 (WE) × (LCR)에 의해 구해집니다.
분석 컬럼의 주입량이 1 ~ 10mg이면 2 × 25cm의 세미 분취용 컬럼의 로딩량은 일반적으로 19 ~ 190mg/injection됩니다.
컬럼 크기 (직경 × 길이)
충전재의 양 (g)
상대적인 주입량 (LCR)
유속 (ml / min)
0.46 x 25 cm
2.50
1
1.0
1 x 25 cm
11.8
5
5.0
2 x 25 cm
47.4
19
19
5 x 50 cm
592
250
50
10 x 50 cm
2370
1000
200
"어떤 규격의 컬럼을 사용해야 합니까?"라는 질문이 자주 있습니다, 그것은 고객이 몇 번에 걸쳐 분취 받을 것인가에 따라 달라집니다. 다음 식을 이용하여 컬럼 크기를 결정할 수 있습니다.
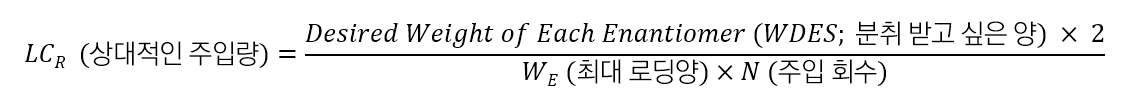
예시 : 분취 목적을 달성하기 위하여 필요한 컬럼의 LCR의 값은 얼마입니까?
문제 : Racemic mixture에서 각 광학 이성질체 1g을 분취해야 합니다. 분석 시간은 30분 이며, 24 시간 동안 48 번 주입하는 것이 타당하다고 판단했습니다. 분석 컬럼을 사용했을 때의 최대 로딩량은 2mg = 0.002g (각 광학 이성질체 1mg 씩)입니다. 48 번 주입으로 각 광학 활성 체 1g을 얻기 위해 요구되는 LCR 값은 얼마가 됩니까?
다음과 같이 계산됩니다.
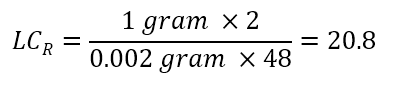
표를 참조하면 이번 최적의 컬럼은 LCR = 2 × 25cm 컬럼 입니다."내가 가지고 있는 세미 분취용 컬럼은 얼마나 샘플 로딩할 수 있을까요?"라는 질문이 많습니다. 우선 분석 컬럼에서 최대 샘플 로딩량을 알아보십시오. 세미 분취용 컬럼의 주입량은 분석 컬럼의 최대 주입량에 세미 분취용 컬럼의 LCR값을 곱함으로써 구할 수 있습니다. 즉, WPREP = WE × LCR입니다. 또한, 분석 컬럼의 주입량에 세미 분취용 컬럼의 LCR 값을 곱하면 그 세미 분취용 컬럼의 주입량이 구해집니다. 즉, VPREP = VAmax × LCR입니다
- 질문컬럼에 압력이 많이 걸려 적절한 유속으로 사용할 수가 없습니다.
- 답변
키랄 컬럼 박스에 동봉된 사용 설명서에 기재된 제한 압력은 컬럼에만 걸리는 압력을 말하며, 시스템 전체에 걸리는 압력이 아닙니다.
예를 들어, 일반적인 분석 조건에서 컬럼을 포함한 시스템 전체에 걸리는 압력이 10MPa이고, 컬럼을 제거하고, Union 또는 공 컬럼을 연결한 상태에서 시스템 전체에 걸리는 압력이 3MPa이면 컬럼 본체에 걸리는 압력은 7MPa입니다.
컬럼 자체 압력이 높은 경우,
컬럼 말단이 시료에 의해 막히는 일이 자주 있습니다.
권장 절차대로 세척하여 입자를 제거 할 수 있습니다.
또한 컬럼 압력 문제를 해결하기 위해 분석 컬럼 또는 분취용 컬럼의 입구 측에 제거 및 교체가 가능한 인라인 필터 혹은 가드 카트리지를 항상 설치하는 것이 좋습니다.
높은 유량으로 분석하는 경우, 권장 최대 압력을 초과하지 않도록 유속을 낮게 설정 해야 합니다.에탄올과 2-프로판올 등 점도가 높은 용매를 이동상으로 사용하면 압력이 높게 걸릴 수 있습니다.
점도가 높은 용매를 이동상으로 사용할 경우, 권장 최대 압력을 초과하지 않도록 유량을 낮게 설정하십시오.
일반적으로 역상 조건에서 RH 시리즈의 컬럼을 사용할 경우, 순상 조건으로 H 시리즈의 컬럼을 사용할 경우보다 유량을 낮게 설정해야 합니다.RH 타입의 역상 컬럼은 점성이 높은 수용성의 이동상을 사용하기 때문에 압력이 높게 걸립니다.
Coated-type 키랄 컬럼 사용 시, 압력이 급격하게 상승하는 경우 심각한 문제가 발생했을 가능성이 있습니다.
샘플 및 이동상이 충전제에 손상을 주는 물질이 소량이라도 포함되어 있으면 컬럼이 급격하게 손상 될 수 있습니다.이러한 상황이 발생하면, 이동상의 카이랄 다당류 유도체 폴리머가 용해되어 유출되며, 컬럼의 압력이 급격히 상승 할 수 있습니다.
컬럼을 연결하지 않은 상태에서 시스템 압력이 지속적으로 상승하거나, 높은 압력에서 안정화 된다면 시스템의 어딘가가 막혀있는 것으로 생각됩니다.
시스템 라인이나 인라인 필터 밸브 부분에 불순물 등을 확인하십시오.
세미 분취용 컬럼을 사용하여, 높은 유속에서 분석하는 경우 시스템의 라인의 내경과 검출기 셀의 양을 늘릴 필요가 있습니다.
또한 권장 최대 압력을 초과하지 않도록 유속을 낮게 설정해야 합니다.
- 질문샘플이 hexane, alcohol 에 용해되지 않습니다. 샘플 용매는 무엇을 사용하면 좋을까요?
- 답변
분석이 목적일 경우, 일반적으로 샘플 농도를 높게 할 필요는 없습니다. 일반적 이동상과 같은 조성의 용제에 1mg/ml 또는 그 이하의 샘플을 용해하면 됩니다.
샘플이 염기성이면 샘플 용매에 Diethylamine을 0.1 % 첨가하십시오. 용해도가 높은 프리 염기가 이동상에 용해성을 개선 할 수 있습니다. 반대로, 샘플이 산성이면 Trifluoro acetic acid 0.1 % 첨가함으로써 샘플 용해성을 개선 할 수 있습니다.
Immobilized type 키랄 컬럼을 사용하는 경우 샘플의 용해성이 높은 다른 이동상을 할 수 있습니다.
분석 목적의 경우 샘플의 주입량이 적기 때문에 샘플 용해 용매가 분석 결과에 영향은 미치는 경우가 거의 없습니다.
특히, 샘플 용해 용매와 이동상이 동일한 정도의 용매 강도를 가진 경우, 샘플 용매에 의한 분석 결과가 다른 경우는 거의 없습니다. 그러나 분취 목적의 경우에는 주입 샘플이 이동상과 섞일 때 샘플이 석출 될 수 있으므로 주의가 필요합니다. 이 경우 이동상의 용해도를 높이기 위해 샘플 용액에 사용하는 용매를 이동상에 섞어 사용하는 것이 좋습니다.
Coated-type 키랄 컬럼을 사용하는 경우 샘플 용매로, 100 % Methanol , Ethanol, Isopropyl Alcohol, Acetonitrile을 사용해 보세요. 이러한 극성 용매는 거의 모든 키랄 컬럼에서 사용할 수 있습니다. 일반적으로 Toluene, Chloroform, Methylene Chloride, tert-Butyl Methyl Ether, Tetrahydrofuran, Acetone, Methyl ethyl ketone, Ethyl Acetate, N, N- Dimethylformamide, Dimethyl sulfoxide, Pyridine 등의 용제를 Coated-type 키랄 컬럼에 주입하는 샘플 용매로 사용하면 안됩니다. 이러한 용매가 샘플에 소량 포함되어있는 경우, Coated-type 키랄 다당류 유도체 폴리머가 용출되어 컬럼 수명이 크게 단축 될 수 있습니다 (압력 상승을 동반하며, 분리능이 크게 감소 됨).
샘플이 수용성 용매에만 용해 될 경우, Immobilized type 키랄 컬럼과 AD-RH / AS-RH / AY-RH / OD-RH / OJ-RH / OZ-RH 컬럼으로 역상 모드에서 분석 하십시오. 역상 모드에서는 이동상과 희석 용매에 Methanol / Water, Ethanol / Water, Isopropyl Alcohol / Water, Acetonitrile / Water을 사용할 수 있습니다. 충전제 별 역상 이동상 조성의 제한 사항은 설명서를 참조하십시오. 키랄 고정상 지지체인 실리카겔이 용해하는 것을 피하기 위해 이동상의 pH는 2 ~ 9 사이에서 사용하고 특히 pH 7 ~ 9에서는 가드 카트리지를 반드시 사용하십시오. - 질문어떤 첨가제를 어떤 농도로 사용하면 피크 모양이 개선됩니까?
- 답변
대부분의 중성 또는 약산성, 약 염기성 샘플은 첨가제를 필요로 하지 않습니다.
따라서, 먼저 첨가물이 없는 상태에서 분석 조건의 탐색 (컬럼 스크리닝)을 실시하는 것이 좋습니다.
강산 또는 강염기 샘플은 다당 유도체 키랄 컬럼에 흡착하기 쉽고, 결과적으로 성분 피크의 테일링과 퍼짐을 볼 수 있습니다.
이 흡착은 컬럼 실리카겔의 활성 부위에서 발생합니다. 이 문제를 극복하기 위해 활성 부위에 선택적으로 흡착되는 화합물을 이동상에 추가합니다.그럼으로써 활성 부위에는 샘플 대신 첨가된 화합물이 흡착하고 샘플이 흡착되지 않습니다.
가장 일반적인 첨가제는 산성 첨가제 : Trifluoro Acetic acid, 염기성 첨가제 : Diethyl amine이 있습니다.
이러한 첨가제는 비극성 용매에 잘 녹고 순상 모드 또는 극성 유기 용제 모드에서 자주 사용됩니다.
이러한 첨가제의 장점은 이동상 용해도가 낮은 샘플의 용해성을 크게 높일 수 있습니다.
Diethylamine, Trifluoro Acetic acid 등과 같은 첨가제는 이동상에 0.5 %를 상한으로 추가 할 수 있습니다. 일반적인 첨가량은 0.1 %입니다.
고객 중에는 처음부터 첨가제를 사용하여 분석 조건의 탐색을 생각하는 분도 계십니다.
일반적인 방법으로 Diethylamine와 Trifluoro Acetic acid을 모두 이동상에 추가하는 방법도 있습니다.
Screening시 첨가제를 사용하는 경우, 첨가제를 넣지 않아도 좋은 경우가 있기 때문에 첨가제의 필요성을 신중하게 검토해야 합니다. - 질문기존에 사용하던 분석 조건에서 분리가 잘 되지 않습니다. 어떻게 해야 기존과 같은 분리 결과를 얻을 수 있나요?
- 답변
컬럼의 능력은 많은 크로마토그래피 인자로 평가됩니다. 예를 들어, 컬럼 효율 (N), 선택성 (α), 분리도 (Rs), 피크 대칭성 (Ps), 압력변화 (ΔP) 등이 있습니다.
컬럼 성능이 변화하는 원인도 많은 것을 생각할 수 있습니다.
그 중 일부는 키랄 컬럼뿐만 아니라 실리카겔 컬럼 등에서도 일어나는 것도 있지만, coated type 키랄 컬럼에서만 특이적으로 발생하는 경우도 있습니다.
일반적으로 컬럼 문제가 발생된 것으로 의심되는 경우, 취급 설명서를 확인하시어 기재된 방법으로 컬럼을 충분히 세척하십시오. 그런 다음 컬럼 박스에 동봉된 성적서를 보시고 같은 조건에서 컬럼을 검사하십시오. 이 검사 결과가 문제의 원인 발견에 중요합니다.
압력 변화가 관측됨
Immobilized type 키랄 컬럼 에서는 압력 상승의 주요 원인은 컬럼 말단에 있습니다.
샘플 또는 이동상 중의 불용해성 물질이 압력 상승을 발생 시킵니다.
또한 이동상보다 용해성이 좋은 용매에 용해 된 샘플을 주입해도 막힘 발생할 수 있습니다.
즉, 용해도가 낮은 이동상과 혼합하여 샘플이 석출되어 컬럼 입구 쪽을 막아 버리는 현상입니다.
이 문제의 해결책은 컬럼 인렛 프릿 (inlet frit)을 세척하거나 교체하는 것입니다.
그러나 컬럼 인렛 프릿 (inlet frit) 을 교체하는 것은 쉽지 않고, 컬럼 충전 상태에 악 영향을 미칠 위험이 있으므로 권장하지 않습니다.
간단한 방법으로 컬럼 흐름 방향과는 반대로 세척 (역세척)하는 방법이 있습니다.
이와 같은 문제를 미연에 방지하기 위해 가드 카트리지를 사용하는 것을 권장합니다.
Coated-type 키랄 컬럼에서 일어나는 급격한 압력 상승은 고정상에 대한 용매의 영향이 있을 수 있습니다.
만약 압력 상승의 원인이 고정상에 사용금지 용매를 사용하여 발생한 경우, 분리능 복구가 안됩니다.
이것을 예방하기 위해서 컬럼을 연결하기 전에 HPLC 장비 전체 (컬럼 연결부위에 union 또는 공컬럼을 연결하여 모든 HPLC 시스템 라인과 오토샘플러 그리고, 오토샘플러 세척용매까지 모든 시스템)를 분석 이동상으로 치환합니다.
분석물 또한 이동상에 용해하여 분석하는 것이 가장 좋습니다.소량의 금지 용매가 섞여 있어도 큰 문제가 아니라고 생각 될지도 모르지만 사용금지 용매가 키랄 폴리머를 용해시켜 컬럼 성능의 급격한 저하의 원인이 됩니다. 컬럼 효율성과 선택성의 현저한 성능저하가 Chromatogram에서 거의 확실하게 볼 수 있을 것입니다. 이러한 경우, Ethanol 및 2 - Propanol을 장시간 흘려주어 다소 개선 할 수도 있지만, 대부분의 경우 컬럼이 완전히 파괴되어 있기 때문에 컬럼 교환이 필요합니다.
압력은 일정하지만, 컬럼 효율이 변화 함.
대부분의 경우 컬럼 효율 변화는 머무름 시간, 피크 대칭성, 피크 모양의 변화를 수반합니다.
드물게 피크 Tailing, Shoulder가 발생하여 컬럼 효율이 떨어지는 것은 컬럼 헤드에 공극이 형성되는 것이 원인이라고 생각됩니다.
이 공극은 이동상 조건 (일반적으로 역상 조건)에 의한 실리카의 용해, 컬럼 내압 이상의 가압, 실리카겔 입자의 파괴 또는 컬럼 초기 충전 문제로 인한 것이 원인입니다. 구입 시에는 컬럼에 동봉되어 있는 성적서에 기재되어 있는 조건에서 컬럼을 검사 해 주시고, 사용 개시 후에도 정기적으로 같은 조건에서 검사를 받는 것으로, 컬럼의 성능에 변화가 없다는 것을 확인 할 수 있습니다. 컬럼 효율 손실의 대부분은 컬럼 말단의 막힘 (압력변화에서 설명) 또는 컬럼 헤드에 물질의 흡착으로 발생할 수 있습니다.
컬럼 헤드에 물질의 흡착은 샘플의 화학적 순도가 낮은 경우, 또는 고정상에 강하게 흡착하는 성분이 샘플에 포함되어 있는 경우 발생 됩니다.
Immobilized type 키랄 컬럼을 사용하는 경우, DMF 등의 용해성이 강한 용매로 세척하여 해결할 수 있습니다. 이 방법은 Coated-type 키랄 컬럼에는 사용할 수 없습니다.
Coated-type 키랄 컬럼의 경우, 사용 가능한 용매 중 용출 힘이 강한 2-프로판올로 세척하십시오.
권장 세척 조건에서 성능이 복구되지 않을 경우에는 보다 강력한 세척이 필요하지만, 이 경우 컬럼이 손상 될 가능성이 커집니다.
이 방법 또한 정보가 필요한 경우 당사로 문의하시기 바랍니다.
그러나 이 방법은 반드시 성공하는 것은 아닙니다. 따라서 가능한 한 Immobilized type 키랄 컬럼을 사용하실 것을 권장합니다.
가끔, 새로운 컬럼을 사용하면 설정 한 분리 조건에서 분리가 재현되지 않을 수 있습니다.
이 현상은 로트 간의 차이에 의한 가능성도 있습니다만, 새로운 컬럼과 지금까지 사용하고 있던 이전 컬럼의 이동상 기록이 원인 인 것이 많습니다.즉, "메모리 효과"로 알려져 있는 이전 컬럼이 사용된 기록 속에서 이동상의 유기 용제가 극 미량이여도 흡착 잔류하고, 분리에 매우 큰 영향을 주고 있을 가능성이 있습니다.
Immobilized type Chiral 컬럼 의 경우 컬럼에 DMF를 흘려주어 "재설정"을 실시하는 것만으로 메모리를 제거 할 수 있습니다.대부분의 경우, 적절한 용매를 포함하여 이동상을 새로운 컬럼에 몇 시간을 흘려주어 문제를 해결할 수 있습니다.
그래도 분리가 복원되지 않으면 다른 이동상, 컬럼 온도에서 분리 조건을 재검토 해야 할 필요가 있습니다.
따라서, 새로운 분석법 검토에 들어갈 때 새 것의 컬럼 또는 사용된 이동상과 샘플을 기록한 컬럼을 사용하시는 것이 좋습니다.컬럼의 분리 이상에 관한 질문이 있으시면 당사에 문의하시기 바랍니다.
귀하의 질문에 지체 없이 정확하게 응답하고자 하오니 가능한 컬럼에 발생한 문제를 기술하여 알려주십시오.
- 질문역상 조건에서 분석하고 싶습니다. 어떤 컬럼과 이동상을 사용할 수 있습니까?
- 답변
키랄 컬럼 이름에 R이 붙는 컬럼과 Immobilized type 키랄 컬럼 을 역상 조건에서 사용하실 수 있습니다.
이동상의 유기 용매 성분으로 THF, Acetone, Dioxane 등을 사용할 수 있는 컬럼은 Immobilized type 키랄 컬럼 입니다.
Alcohol (Methanol , Ethanol, 2 - Propanol)와 Acetonitrile은 모든 컬럼에서 사용 할 수 있습니다.
일반적인 역상 컬럼에서 사용 되는 버퍼는 사용 가능하지만, 컬럼에 동봉된 사용 설명서를 참조하시어, 적절한 농도와 버퍼를 선택하십시오.
Immobilized type 키랄 컬럼, Coated-type 키랄 컬럼 모두 pH 2 ~ pH 9 범위에서 안정적으로 사용할 수 있습니다.pH 2 포름산 수용액과 pH 9 20mM 탄산 수소 암모늄 수용액 (Diethylamine 첨가하여 pH를 조정)가 각각 산성, 염기성 샘플에 대한 첫번째 권장 이동상 용매입니다.
위 조건에 만족스러운 분리를 얻을 수 없는 경우, pH 2 Phosphoric acid 수용액과 pH 9, 20mM 붕산 완충액을 각각 산성, 염기성 샘플에 사용하십시오.그러나 이러한 용매는 초기 검토 권장 사항이라는 점에 유의하십시오.
더 낮은 농도의 완충액 또는 pH 2에서 pH 9 사이에서 가장 좋은 분리를 얻을 수 있는 경우가 많습니다.
또한 셀룰로오스 계의 컬럼은 염기성 샘플에 Ion chromatography를 이용한 0.1M Potassium hexafluorophosphate 수용액에서 좋은 분리를 얻을 수 있습니다.
더욱 상세한 내용은 본 홈페이지의 핸드북을 참조하여주십시오.
- 질문키랄 컬럼에는 어떤 용매를 사용할 수 있습니까?
- 답변
키랄 컬럼 사용 전에 컬럼과 함께 제공되는 설명서를 반드시 확인하시기 바랍니다.
Immobilized type 키랄 컬럼 (CHIRALPAK IA / IB / IC / ID / IE / IF /IG /IH)는 어떤 용매도 사용할 수 있지만, Coated-type 키랄 컬럼에서 사용 가능한 용매는 제한되어 있습니다. 그러나 다음의 간단한 예방 조치를 취해 주시는 것만으로, 컬럼 장기간 안정되게 사용할 수 있습니다.
설명서에는 사용 가능한 용매가 설명되어 있습니다. 설명서의 첫머리에 표시된 사용 금지 용매에 관한 주의 사항을 꼼꼼히 확인하시기 바랍니다. 또한 혼합 용매로 허용 범위에 있는 용매도 정리되어 있습니다.
3가지 종류의 용매의 혼합은 다당 고분자의 용해도가 알려져 있지 않습니다. 고정상인 다당 Polymer의 용해도를 높여, 컬럼의 성능을 떨어뜨릴 가능성이 있습니다.
Immobilized type 키랄 컬럼과는 달리 기존의 Coated-type 키랄 컬럼에서는 Dichloromethane, Chloroform, THF, DMSO와 같은 용매는 절대 사용하지 마십시오.이와 같은 용매를 사용하면 컬럼 헤드에서 다당 고분자가 용해되며, 사용 금지 용매가 희석 될 시, Polymer가 다시 침전하여 압력이 크게 상승하면서 컬럼을 막히게 합니다.
샘플 용해 용매로 사용 된, 또는 시스템 라인 (오토 샘플러 라인 포함)에 남아 있던 사용 금지 용매가 소량이라도 혼입되면 컬럼의 성능을 저하시키거나 컬럼을 파괴하는 원인이 됩니다. 샘플 중에 미량이라도 사용 금지 용매가 남아있는 경우도 컬럼 수명을 단축시킬 수 있습니다.
이러한 이유에서 Immobilized type 키랄 컬럼, CHIRALPAK IA / IB / IC / ID / IE / IF/ IG/ IH 의 사용을 추천합니다.
특정 용매를 고객님의 보유 컬럼에서 사용할 수 있는지 모르는 경우 사용하기 전에 문의하시기 바랍니다.
- 질문광학이성질체 분리를 위해 어떤 컬럼을 사용하면 좋을까요?
- 답변
씨티케이는 키랄 컬럼 스크리닝 서비스를 실시하고 있습니다.
소량의 Racemic 샘플(10~20mg)을 씨티케이로 보내주시면 분석 서비스를 해드립니다. 가장 최적의 Chiral 컬럼, 분석 조건을 제공해드립니다 (고객님의 요청에 따라 비밀 유지 계약을 체결하고 있습니다).
분석에 소모되는 시간은 샘플 수령 후 3일 정도 입니다. 3일 안에 분석이 완료되지 않더라도 1차 보고 드리고 있습니다. Chiral Center가 2개 이상 포함된 화합물의 경우, 많은 검토가 필요하며 Screening 및 최적화에 소모되는 시간이 더 길어질 수 있습니다.
분리 대상 화합물의 구조를 보내주시면 문헌 검색 및 기술 지원을 해 드립니다. 구조 공개가 어려운 경우 유사한 구조를 가진 일반적인 화합물 이름 또는 특정 유도체 화합물 이름을 보내주시면 구조 검색을 할 수 있습니다.
Daicel사의 Chiral 컬럼을 사용한 키랄 화합물의 분리 데이터가 이미 많은 문헌에 보고 되어 있습니다.이 검색을 바탕으로 고객의 화합물에 가장 적합한 컬럼을 추천해드립니다. 키랄 컬럼 선택을 위한 어플리케이션 가이드에는 1000개 이상의 일반적인 Racemic 화합물의 분리 데이터가 게재되어 있습니다
참고 : https://blog.naver.com/no1ctk/221706353406
- 질문Immobilized type Chiral column을 사용하여 분석 방법을 개발하는 경우, 어떻게 진행하면 될까요?
- 답변
Immobilized type 키랄 컬럼 은 Coated-type 키랄 컬럼보다 용매 선택의 폭이 넓습니다.
샘플 구조에 대한 정보만으로 키랄 컬럼의 선택성을 예측하기 어려우므로 컬럼 Screening을 통해 결정합니다.
당사에서는 다양한 용매 조합을 실시하였고, 초기 분석으로 우수한 분리 결과를 얻을 수 있으며 Screening의 시간을 단축하기 위한 4가지의 용매 조합을 확인했습니다.아래의 표는 분리 성공률이 높은 주요 이동상 조성입니다. 이러한 이동상 중 한 가지를 선택하여 Screening을 진행하십시오. 그 결과에 따라 적절한 머무름 시간을 조정하기 위해서 이동상 용매 세기를 조절하십시오. 예를 들어 Peak가 너무 빨리 검출되는 경우 용매 세기가 약한 Hexane의 비율을 높여 줍니다. CH2Cl2 등의 할로겐 계 용매 등은 Immobilized type 키랄 컬럼 에서만 사용할 수 있습니다.
우선 추천
심사 용매alkan ※ 1 /
2 - 프로판올alkan ※ 1 /
에탄올alkan ※ 1 / MTBE ※ 2 /
에탄올alkan ※ 1 /
CH2Cl2 ※ 3 (/ 에탄올)일반적인 초기 조건
(v / v / v)80:20
80:20
0:98:2
50:50
권장 조성 범위
(v / v / v)99:1 ~ 50:50
99:1 ~ 50:50
90:10:0 (0:100:0) ~
0:60:40 (0:60:40)85:15 ~ 0:100
둘째 추천
screening 용매alkan ※ 1 /
THFalkan ※ 1 /
초산 에틸 ※ 4alkan ※ 1 /
CHCl 3 ※ 3아세토 니트릴 /
알코올류 ※ 5메탄올 /
기타 알코올류일반적인 초기 조건
(v / v / v)70:30
50:50
70:30
100:0
100:0
권장 조성 범위
(v / v / v)95:5 ~ 0:100
80:20 ~ 0:100
85:15 ~ 0:100
80:20 ~ 0:100
100:0 ~ 0:100
※ 1 : n-Hexane, iso-Hexane, n-Hepane. Alkane의 종류에 따라 다소 분리가 다를 수 있습니다.
※ 2 : 용매 세기가 약한 MTBE를 이동상으로 사용하고, Ethanol을 적절히 첨가함으로써, 좋은 분리 결과를 얻을 수 있습니다. 반대로 극단적으로 머무름이 약한 화합물의 경우 Alkane과 MTBE 혼합 용매를 사용하여 분석할 수 있습니다.
※ 3 Chloroform, Dichloromethane (DCM) 등 비교적 용출 힘이 약한 이동상을 사용하는 경우, Alcohol (Ethanol, Methanol , 2 - Propanol)을 1 ~ 5 % 정도 첨가하여 컬럼 내에서의 머무름과 피크 모양을 조절함으로써 더 좋은 분리를 얻을 수 있습니다. 샘플의 머무름이 너무 강한 경우에는 Dichloromethane에 20 %의 Ethanol을 첨가하는 것이 효과적입니다. 분석 물질에 따라 DCM 등 용매가 강한 이동상이 될 수 있습니다.
※ 4: 머무름이 강한 화합물의 경우, Alcohol (Ethanol, Methanol , 2 – Propanol) 또는 THF을 Ethyl acetate 에 첨가하여 용출 시간을 단축 할 수 있습니다.
※ 5: Methanol , Ethanol, 2 – Propanol 또는 THF.
※ 이동상 선택 (특히 Acetone, 에틸 아세테이트, Toluene, 고농도의 Chloroform 등)와 샘플의 구조에 따라 UV 검출기에 의한 검출이 어려울 수 있습니다. 그 경우, RI 검출기 나 증발 광 산란 검출기 (ELSD) 등 UV 흡수에 좌우되지 않는 검출기를 사용하십시오. - 질문Immobilized type 키랄 컬럼에 사용하는 유기 용매 및 첨가제는 Coated-type 키랄 컬럼과 차이가 있습니까?
- 답변
Immobilized type 키랄 컬럼에는 Coated-type 키랄 컬럼에서 사용할 수 있는 모든 첨가물을 사용할 수 있습니다.
염기성 샘플을 분석할 때 Diethylamine (DEA), 산성 샘플을 분석할 때 Triflouro acetic acid (TFA)를 우선 검토합니다.
첨가물의 일반적인 사용 방법은 아민 작용기를 가진 샘플의 경우 염기성 첨가제를 추가하면, 머무름이 증가되며, 피크가 샤프하게 분리됩니다.
유기 용매의 경우, Immobilized type 키랄 컬럼과 Coated-type 키랄 컬럼에 차이점이 있습니다.
컬럼에 동봉된 설명서를 참조하시어, 사용하실 이동상의 종류와 조성이 분석하시려는 컬럼에서 사용할 수 있는지 반드시 확인하여 주십시오.
CHIRALPAK IB에서 염기성 샘플을 분석하는 경우 첨가제로 DEA를 사용하는 것보다 Ethanol amine (EtNA), n-butylamine 특히 Ethylene diamine (EDA)을 사용하는 것이 선택성 및 피크 모양을 향상시킬 수도 있습니다.
- 질문Immobilized type 키랄 컬럼을 사용하는 장점은 무엇입니까? Coated-type 키랄 컬럼과 Immobilized type 키랄 컬럼 중 무엇을 선택해야 합니까?
- 답변
새롭게 분석법을 개발할 시에 Immobilized type 키랄 컬럼 사용을 추천 드립니다. Immobilized type 키랄 컬럼 은 Coated-type Chiral 컬럼 보다 높은 안정성을 보장합니다. 또한 Immobilized type 키랄 컬럼은 THF, Ethyl acetate, 염소계 용매 등 강력한 용매에 대해서도 안정적으로 사용할 수 있는 장점이 있습니다. 이러한 용매를 사용할 시 기존에 사용한 이동상 조건과 비교하여 다른 선택성을 나타내어 분리 가능성이 높아집니다. 분취 Chromatography 용도에서도 이러한 용매를 사용하면 샘플의 용해성을 높이고 효율적으로 분취하여 생산성을 높일 수 있습니다.
기존의 Coated-type 키랄 컬럼으로 기시법 등이 지정되어 있어 Immobilized type 키랄 컬럼 으로 승인이 나지 않은 경우에 Coated-type 키랄 컬럼을 사용하시는 것이 적합합니다. 또한 Immobilized type 키랄 컬럼에서 다양한 용매를 이용하여 분석 조건을 검토하였으나 충분한 분리를 얻을 수 없는 경우에 Coated-type 키랄 컬럼을 사용하십시오.
- 질문Immobilized type 키랄 컬럼을 사용할 때, 이동상 이외의 용매에서 샘플을 용해하여도 좋습니까?
- 답변
일반적으로 샘플을 이동상에 용해 시키는 것이 가장 최적입니다.
주입 샘플링을 할 때 이동상보다 강한 용매를 사용하실 경우 용매효과 (Solavation)을 주의하십시오.
피크 모양이 변형 되거나 검출되거나 분석결과에 영향을 미칠 수 있습니다.
분취용 Chromatography에서는 잘 녹는 용매에서 녹인 후 컬럼에 주입 시 고농도의 샘플이 상대적으로 이동상에 잘 녹지 않는다면 석출되는 위험이 있습니다.
만약 컬럼과 샘플의 흡착이 이동상 용출 힘보다 크게 되면 새로운 문제가 발생합니다.
이러한 경우 샘플이 CSP에 흡착하여 컬럼에 잔존하여 선택성 및 향후 분취 효율에 영향을 미칩니다 (Memory effect).
종종 샘플 용해 용매에 Dimethylsulfoxide (DMSO)가 사용되는 경우가 있습니다.
이 용매는 Immobilized type 키랄 컬럼 성능에 영향을 미치지는 않지만, 이동상 조성에 따라 컬럼에 DMSO가 흡착할 수 있습니다.
DMSO로 희석한 샘플을 반복 주입한 경우에 CHIRALPAK IA에서 효율의 감소가 서서히 발생하지만, DMF 가끔 세척함으로써 성능을 복원할 수 있습니다.
CHIRALPAK IB는 DMSO에 희석한 시료의 주입은 권장하고 있지 않습니다. CHIRALPAK IB에서는 DMSO가 흡착되어 효율이 현저히 저하 될 것입니다.
CHIRALPAK IB에 흡착된 DMSO를 제거하고자 할 때는 컬럼을 역으로 장착하여 흘려 주시면 됩니다.
DMSO, DMF, DCM 등 용매 조건하에서도 Immobilized type 키랄 컬럼은 내구력 면에서 안정적으로 사용할 수 있습니다. - 질문Immobilized type 키랄 컬럼에 어떤 용매를 사용할 수 있습니까? 사용할 수 없는 용매가 있습니까?
- 답변
현재 Immobilized type 키랄 컬럼에 수명에 영향을 미치는 유기 용매는 알려져 있지 않습니다.
Hexane or Heptane/Alcohols, Methanol, Isopropanol, Ethanol, Acetonitrile, Dichloromethane, Chloroform, Tetrahydrofuran, Ethyl Acetate, Acetone, Methyl acetate, MTBE, Dimethylformamide (DMF), Dimethylacetamide (DMAc) 등 많은 유기 용매를 사용할 수 있습니다.
용출 되지 않고 컬럼에 잔존해 있는 화합물 및 불순물은 Dimethylformamide, THF, Ethyl acetate와 같은 용매를 흘려주어 세척할 수 있습니다.
pH ≧ 7.0에서 분석하는 경우, 가드 카트리지를 이용하여 분석 온도는 25 ℃ 이하에서 사용하십시오.
역상 조건에서 분석하는 경우, 컬럼은 pH 2.0 ~ pH 9.0의 범위에서 사용하십시오.가드 카트리지는 pH ≧ 7.0에서 약 200회 주입 시 교체하십시오.
- 질문CHIRALPAK IA, IB, IC, ID, IE, IF, IG, IH 는 각각 어떤 차이가 있을까요?
- 답변
CHIRALPAK IA, IB, IC, ID, IE, IF, IG, IH 의 분리 작용은 상호 보완적이며 서로 다른 키랄 화합물 군을 분리 할 수 있습니다.
1개의 키랄 물질이 1 개의 컬럼에서만 분리되는 것이 아니라 여러 컬럼에서 분리될 수 있습니다.
일반적으로 AD-H로 분리하는 화합물은 같은 이동상에서 CHIRALPAK IA 에서 분리가 되는 경향이 있습니다.
마찬가지로 OD-H로 분리하는 화합물은 같은 이동상에서 IB로 분리가 되는 경향이 있습니다.
이러한 경우 필요에 따라 용매의 극성을 약간 변경하여 머무름 시간을 조정하시면 됩니다.
CHIRALPAK IC, ID는 위의 2 개의 컬럼과 분리 가능한 화합물이 겹치는 경우도 있으나, 특징적인 선택성을 나타내는 컬럼입니다.
Immobilized type 키랄 컬럼 (IA, IB, IC, ID, IE, IF, IG, IH)을 이용할 경우 기존에 사용하는 이동상 (Hexane / Alcohol) 이외에 더 폭 넓은 이동상을 사용하여 매우 많은 광학 이성질체 분리가 가능합니다.